Миостатин. Биохимия и физиология
В данной статье речь пойдет о...
В данной статье речь пойдет о миостатине, относительно недавно обнаруженном биологически активном веществе, которое оказывает существенное влияние на мышечный рост. Тема, касающаяся миостатина, очень актуальна в настоящее, и Рунeт буквально пестрит статьями о миостатине, но, к сожалению, они носят чаще всего фантастический характер. Осветим ситуацию с миостатином через призму современных научных статей и исследовательских работ, а не популярных журналов и газет.

Мышечная дифференцировка
Вместе с многоядерными волокнами, в скелетных мышцах присутствует небольшое число одноядерных клеток, в числе которых имеются клетки, дифференцированные по мышечному типу. Эти клетки обычно называют сателлитными. Сателлитные клетки расцениваются как стволовые клетки, поскольку основное время своей жизни они находятся в покоящемся состоянии, но активируются и вступают в клеточный цикл после повреждения мышечной ткани.
Установлено, что делящиеся потомки сателлитарных клеток способны участвовать в формировании новых мышечных волокон и образовывать клеточные культуры при выращивании их in vitro. Такие одноядерные мышечные клетки чаще всего обозначают термином миобласты.
Недавно полученные результаты свидетельствуют о том, что в мышцах взрослых особей существует, как минимум, две популяции стволовых клеток, одна из которых представлена типичными клетками сателлитами, а другую составляют так называемые мультипотентные стволовые клетки. И те и другие обуславливают мышечную гиперплазию.
Установлено, что и само возникновение поперечно полосатых мышц на ранних стадиях онтогенеза, и их дальнейшее развитие являются следствием многих молекулярных процессов, протекающих не только в самих мышечных клетках, но и в других тканях и органах организма. Эти процессы обеспечиваются рядом особых гормонов и ростовых факторов.
Большое число ученых, спортсменов и бодибилдеров любителей и просто людей, желающих иметь более совершенную фигуру, крайне заинтересованы в использовании подобных ростовых факторов. С их помощью можно добиться практически любых размерных, силовых и скоростных показателей за короткие сроки.
Надо заметить, что в течение последних десятилетий поиски средств восстановления и увеличения мышечной массы велись не только с применением низкомолекулярных анаболических и антикатаболических препаратов, а также биологически активных пищевых добавок, но и на уровне поиска генов ответственных за гомеостаз мышечной ткани.
Открытие миостатина
Открытие миостатина стало логическим следствием бурного развития молекулярно-генетических методов и фактически совпало с началом формирования нового фронта исследований — функциональной геномики. Во второй половине 90-х был начат поиск в геноме мыши новых генов, которые способны кодировать белки, относящиеся к одному из наиболее важных семейств ростовых факторов, так называемых transforming growth factor.
Для этой цели были использованы полимеразная цепная реакция с праймерами, которыми стали олигонуклеотиды, комплементарные определенным консервативным участкам в последовательностях известных ростовых факторов данного семейства, а также ряд других молекулярно генетических методов. Далее продукты амплификации (длиной около 280 нуклеотидов) были использованы как зонды для скрининга кДНК библиотеки мышечной ткани мыши.
Переломным моментом в этих поисках стал 1997 год, когда под руководством Se-Jin Lee в Johns Hopkins University School of Medicine, Baltimore удалось выявить ДНК клон, содержащий открытую рамку считывания для последовательности в 376 аминокислот.
Анализ обнаруженной последовательности показал, что она обладает рядом особенностей, характерных для семейства TGFß. Таким образом, авторы вполне обоснованно стали рассматривать обнаруженную ими кДНК последовательность, как продукт гена, кодирующего новый белок из TGFß семейства, и назвали предсказанный продукт фактором TGF 8 (Growth and Differentiation Factor 8 или, в переводе, — фактор роста и дифференцировки N8), а позднее миостатин.
Функциональная роль миостатина
Однако наибольший интерес и внимание вызвали результаты экспериментов, направленных на выяснение функциональной роли TGF 8. Сначала конструирование мышей мутантов по гену миостатина показало, что такие животные по сравнению с обычными достигают существенно большего веса тела (135%).
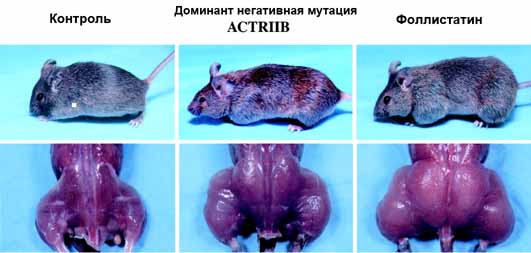
При этом увеличение веса обеспечивалось практически за счет мышечной массы, и вес некоторых мышц у гомозигот более чем в 2 раза превышал вес аналогичных мышц у контрольных животных. Поперечное сечение миофибрилл у мышей нуль мутантов оказалось значительно большим, чем у мышей дикого типа (С57Bl), что указывало на развитие мышечной гипертрофии. В итоге авторы пришли к заключению о том, что миостатин (TGF 8) каким-то образом подавляет рост скелетных мышц, и именно поэтому предложили назвать этот фактор миостатином.

Еще одним объектом для обнаружения генов миостатина были породы мясного скота с фенотипом так называемой «удвоенной мышечной массы». Особи с таким фенотипом («Double muscling») были описаны еще в XIX веке и к настоящему времени хорошо охарактеризованы как специальные породы, например, Belgian Blue или «Бельгийская голубая», Piedmontese и Asturiana de los Valles.
Мышечная масса этих животных уже при рождении несколько выше, чем у телят других пород, а вес жировой ткани и костей в процентном отношении снижен. Для взрослых особей с «Double muscling» фенотипом наблюдается ярко выраженное усиление развития скелетной мускулатуры (в среднем на 20% больше, чем у животных других пород), которое обеспечивается в основном за счет гиперплазии — повышенного количества мышечных волокон.

При анализе гена миостатина у Belgian Blue была обнаружена делеция в экзоне 3, охватывающая 11 нуклеотидов (позиции 937–947) и вызывающая сдвиг рамки считывания в функционально важной области, кодирующей зрелый миостатин. Грубо говоря, была выявлена мутация гена миостатина. Более того, у этих коров делеция оказалась в гомозиготном состоянии, то есть они являлись фактически нуль мутациями по гену миостатина, не способными к синтезу миостатина.
Имеются косвенные указания на то, что посттрансляционный процессинг промиостатина обеспечивает металлопротеиназа, действие которой блокируют специфические ингибиторы.
Установлено также, что «зрелый» миостатин секретируется в межклеточную среду и затем оказывается в плазме крови, где тестируется как myostatin immunoreactive protein. По имеющимся данным, основная часть циркулирующего в крови миостатина входит в состав особого белкового олигомерного комплекса, где кроме зрелого миостатина, присутствуют пропептид из 243 аминокислотных остатков (продукт процессинга промиостатина), фоллистатин и фоллистатин родственные белки, о которых речь пойдет позднее.
Как отмечалось ранее, особый интерес к миостатину возник в связи с тем, что уже в самых первых публикациях, посвященных этому фактору, был сделан вывод о том, что миостатин каким-то способом подавляет развитие скелетной мускулатуры, поскольку в его отсутствие наблюдается увеличение мышечной массы за счет гипертрофии и гиперплазии мышечных волокон.
В последующем ученые отметили, что при определенных условиях блокирование действия миостатина приводит только к гипертрофии, но не вызывает гиперплазию мышц, тогда как другие авторы сообщили о миссенс мутации в гене миостатина, сопровождающейся гиперплазией мышц мыши при отсутствии признаков гипертрофии.
По всей вероятности, эти материалы не столько противоречат друг другу, сколько указывают на сложность и многообразие механизмов, обеспечивающих влияние миостатина на скелетную мускулатуру.

Важно отметить, что по имеющимся данным при блокировании действия миостатина наблюдается не только увеличение мышечной массы, но и повышение силовых характеристик скелетных мышц. С другой стороны, при изучении биологических эффектов миостатина была выявлена корреляция между его высокой продукцией и дистрофическими изменениями скелетной мускулатуры (вплоть до кахексии).
Эти результаты вполне соответствовали данным, полученным в опытах на моделях, в частности, на клеточных культурах, где удалось продемонстрировать ингибирование пролиферативной активности миобластов после внесения миостатина в культуральную среду.
Более того, было установлено (и для человека, и для многих высших млекопитающих), что миостатин тормозит синтез сократительных и других мышечных белков, в результате чего замедляется формирование скелетных мышц или возникает истощение (кахексия). Вследствие этого появилась гипотеза о том, что по принципу обратной связи миостатин, продуцируемый мышцами, играет роль специфичного физиологического регулятора их роста.
Иными словами, миостатин был охарактеризован как один из важных факторов в поддержании равновесия сложных биохимических процессов, которые обеспечивают белковый обмен и связанные с ним процессы формообразования скелетных мышц (гипертрофия и гиперплазия в онтогенезе).
Эволюционная и физиологическая роль миостатина
Возможно, у вас возникнет вопрос, а зачем вообще нужны эндогенные подавители мышечного роста, если как раз его многим и недостает? Резонный вопрос, и он уже даже ближе не к физиологии, а к философии, потому что напрямую касается основного закона диалектики «о борьбе и единстве противоположностей».
Дело в том, что физиология человека практически полностью подчиняется этому закону, все системы имеют две противоположности, они обеспечивают как высокую реактивность, так и постоянство внутренней среды организма. Особенно это актуально для гуморальной системы, где любой эффект обеспечивается двумя группами гормонов: первая группа обладает положительным действием, а вторая отрицательным.
Казалось бы, что может быть достаточно одной группы, допустим, положительных. В случае с мышечной тканью в эту группу будут входить гормон роста, анаболические стероиды, инсулин и прочие гормональные субстанции с анаболическим эффектом. Однако практика показывает, что для того, чтобы система была максимально стабильной и в тоже время реактивной в адекватных пределах нужен диалектический противовес, и его роль исполняет миостатин, кортизол, минералокортикоиды (в какой-то степени) и другие, еще не открытые по мнению ученых гормоны, подобные миостатину.
Гормоны с отрицательным эффектом нужны для того, чтобы сдерживать потенциал, который может внезапно потребоваться в момент перемены условий внешней среды. В противном случае, анаболические гормоны будут приводить к постоянному росту мускулатуры, как бы мало их не было, а это с позиций эволюции и физиологии не всегда полезно для выживания.
Механизм действия миостатина
Вернемся к механизму действия миостатина. С учетом особенностей структуры миостатина и его гена, которые предопределили включение данного фактора в семейство TGFß, появились предположения о том, что некоторые рецепторы, обеспечивающие работу других TGF факторов, могут передавать внутрь клетки и миостатиновый сигнал.
Позднее было показано, что функционирование многих членов семейства TGFß включает связывание с трансмембранными рецепторами, которые обладают серин/треонин протеинкиназной активностью и вызывают фосфорилирование так называемых Smad белков.
Для проверки предположения о существовании подобного механизма для миостатина и с целью выявления рецепторов, способных узнавать данный фактор и обеспечивать передачу его сигнала внутрь клетки, была проведена большая работа с использованием самых различных подходов — от создания трансгенных животных с нарушениями в функционировании определенных молекул мишеней, до прямого анализа связывания миостатина с предполагаемым рецептором в условиях конкуренции с другими факторами — антагонистами миостатина.
Первым этапом в этих поисках стали эксперименты с культивируемыми клетками, которые трансфецировали векторами, несущими полноразмерные последовательности, кодирующие различные рецепторы для факторов семейства TGFß, а точнее: TFGßRII, BMPßRII (для факторов BMP — Bone Morphogenetic Proteins), ActRIIA и ActRIIB.
Оказалось, что только клетки, экспрессирующие ActRIIB, способны эффективно и специфически связывать рекомбинантный меченый миостатин. При этом заметно меньшее сродство данного лиганда наблюдалось к рецептору ActRIIA, а с остальными рецепторами связывания не регистрировалось. Соответственно, дальнейшие исследования сконцентрировались наизучении ActRIIB и ActRIIA.
ActRIIB и ActRIIA ранее были охарактеризованы как рецепторы, работающие с особой группой факторов, относящихся к суперсемейству TGFß, — активинами и ингибинами, близкими по структуре белками, участвующими в различных видах клеточной дифференцировки.
Активины были открыты в конце 80 х годов по их способности активировать секрецию фолликулостимулирующего гормона, что и стало основанием для нескольких вариантов их названия.
Выполненные в последние годы многочисленные исследования структурных и функциональных свойств активинов убедительно показали, что эти регуляторные факторы участвуют в обеспечении различных молекулярных процессов у позвоночных, хотя ряд вопросов еще далеко не ясен.
Наряду с активинами, интенсивно изучаются очень близкие к ним по структуре факторы ингибины (димеры с молекулярной массой около 32 кДа), которые способны подавлять секрецию фолликулостимулирующего гормона.
Фоллистатины и родственные им белки
В целом ряде работ было показано, что взаимодействие активина с рецепторами ActRIIB и ActRIIA может ингибироваться одноцепочечным белком, получившим название фоллистатин, который вначале был описан как фактор, способный блокировать действие фолликулостимулирующего гормона.

В дальнейшем было обнаружено еще несколько белковых факторов, родственных фоллистатину по строению и функциям, которые взаимодействуют с активинами.
Таким образом, в настоящее время имеются достаточно веские основания рассматривать активины, ингибины, фоллистатины, родственные им белки и соответствующие рецепторы как одну из важнейших регуляторных систем в организме позвоночных, которая контролирует не только репродуктивную функцию (через фолликулостимулирующий гормон), но и многие другие процессы, в частности фоллистатин вызывает мышечный рост.
По этому поводу были проведены отдельные исследования, в ходе трансгенные животные, которым ввели генетическую конструкцию, продуцирующую фоллистатин, продемонстрировали впечатляющие развитие мышечной системы.
У таких животных поперечное сечение мышечных волокон в среднем увеличивалось на 28% по сравнению с контролем (гипертрофия), а рост количества миофибрилл (гиперплазия) составил 66%.
Таким образом, удалось продемонстрировать, что избыточная продукция фоллистатина, по видимому, снижает активность миостатина и, в целом, ведет к тем же биологическим эффектам в мышечных тканях, которые достигаются при блокировании рецепторов ActRIIB. Эти данные вполне коррелируют с наблюдениями за мышами, которые имели нокаут мутации в гене фоллистатина.
Эти животные характеризовались заметным снижением мышечной массы при рождении, множественными дефектами развития и быстрой гибелью в перинатальном периоде, что, возможно, отчасти связано с действием миостатина, полностью освобожденного от ингибирующего эффекта фоллистатина.
Фотогаллерея
Знаменитая фотография «накачанной» борзой

И Richard Sandrak, у которого врожденная мутация гена миостатина, будучи еще ребенком имеет степень развития мускулатуры выше, чем у многих взрослых

Flex Wheeler — известный бодибилдер

